- MERCURE (élément chimique)
- MERCURE (élément chimique)Le mercure, élément chimique de numéro atomique 80, est le seul métal liquide à la température ordinaire. Il tire son symbole Hg du mot grec latinisé hydrargyrum (argent liquide). Le mot actuel a été introduit au VIe siècle par les alchimistes qui le représentaient par le symbole de la planète Mercure. L’ancien nom français vif-argent est conservé en allemand (Quecksilber ). Le mercure appartient avec le zinc et le cadmium aux éléments du groupe IIb du tableau périodique. À l’état fondamental, sa structure électronique est caractérisée par une sous-couche 5d saturée et par la présence d’un doublet électronique en 6s . Tandis que les éléments de la colonne Ib (Cu, Ag, Au) peuvent perdre un ou deux électrons d pour donner des ions ou des complexes aux degrés d’oxydation + II et + III, cela n’est plus possible pour les éléments IIb et tout particulièrement pour le mercure dont le degré d’oxydation maximal sera de II. Les orbitales 5d des couches saturées de l’atome de mercure n’interviennent jamais dans la formation des liaisons. L’inertie totale de la sous-couche 5d est une propriété caractéristique du mercure. Pour cette raison, il ne sera pas considéré comme élément de transition bien qu’il possède quelques analogies avec ceux-ci, en particulier la formation de nombreux complexes de coordination. Les propriétés du mercure sont liées à la tendance des seuls électrons 6s à donner des liaisons. Ces électrons étant relativement inertes, la réactivité chimique de l’élément est faible.PréparationLa production mondiale annuelle de mercure est passée de 6 000 t en 1988 à 3 650 t en 1991, en provenance principalement de l’ex-U.R.S.S., de la Chine, du Mexique, de l’Espagne, de l’Algérie et des États-Unis.Le mercure se rencontre à l’état naturel essentiellement sous forme de sulfure rouge appelé «cinabre». Très simple, l’extraction à partir du cinabre s’effectue par grillage du minerai à l’air:
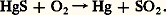 Le mercure distillé est entraîné par l’anhydride sulfureux et l’air en excès; les 0,154 nmvapeurs sont recueillies dans de l’eau acidulée froide dans laquelle le mercure se condense. Ce mercure, impur, est purifié par un premier lavage à l’acide nitrique dilué qui élimine les métaux plus oxydables que lui; un affinage supplémentaire est souvent indispensable pour éliminer l’or et l’argent qui restent dans le métal. Un troisième stade de la purification consiste en une distillation sous vide. Le contrôle de la pureté du mercure s’effectue par voie électrolytique, par comparaison du potentiel électrochimique du métal préparé avec celui d’un mercure étalon.Propriétés physiques et chimiquesLes principales propriétés physiques sont données au tableau 1. Le mercure possède huit isotopes naturels de nombres de masse 196, 198, 199, 200, 201, 202, 203, 204; il existe de nombreux isotopes artificiels. À l’état solide, la structure du mercure est rhomboédrique; c’est le plus volatil de tous les métaux; sa vapeur est monoatomique (le mercure étant le seul élément, en dehors des gaz rares, qui donne une vapeur monoatomique à des températures relativement basses).Le mercure est bon conducteur de l’électricité; il est, d’autre part, diamagnétique.La chimie du mercure est unique sous plusieurs aspects. Le mercure forme deux séries de composés: les composés mercuriques dans lesquels l’atome est bicovalent et dont le comportement rappelle les composés analogues du cadmium; les composés mercureux qui contiennent l’ion (Hg 漣Hg)2+. Une étude des équilibres entre le mercure et les sels mercureux et mercuriques est indispensable à la compréhension des propriétés chimiques. Les constantes thermodynamiques importantes sont les valeurs des potentiels normaux d’oxydo-réduction des équilibres suivants:
Le mercure distillé est entraîné par l’anhydride sulfureux et l’air en excès; les 0,154 nmvapeurs sont recueillies dans de l’eau acidulée froide dans laquelle le mercure se condense. Ce mercure, impur, est purifié par un premier lavage à l’acide nitrique dilué qui élimine les métaux plus oxydables que lui; un affinage supplémentaire est souvent indispensable pour éliminer l’or et l’argent qui restent dans le métal. Un troisième stade de la purification consiste en une distillation sous vide. Le contrôle de la pureté du mercure s’effectue par voie électrolytique, par comparaison du potentiel électrochimique du métal préparé avec celui d’un mercure étalon.Propriétés physiques et chimiquesLes principales propriétés physiques sont données au tableau 1. Le mercure possède huit isotopes naturels de nombres de masse 196, 198, 199, 200, 201, 202, 203, 204; il existe de nombreux isotopes artificiels. À l’état solide, la structure du mercure est rhomboédrique; c’est le plus volatil de tous les métaux; sa vapeur est monoatomique (le mercure étant le seul élément, en dehors des gaz rares, qui donne une vapeur monoatomique à des températures relativement basses).Le mercure est bon conducteur de l’électricité; il est, d’autre part, diamagnétique.La chimie du mercure est unique sous plusieurs aspects. Le mercure forme deux séries de composés: les composés mercuriques dans lesquels l’atome est bicovalent et dont le comportement rappelle les composés analogues du cadmium; les composés mercureux qui contiennent l’ion (Hg 漣Hg)2+. Une étude des équilibres entre le mercure et les sels mercureux et mercuriques est indispensable à la compréhension des propriétés chimiques. Les constantes thermodynamiques importantes sont les valeurs des potentiels normaux d’oxydo-réduction des équilibres suivants: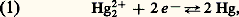 avec E0 = 0,789 V;
avec E0 = 0,789 V;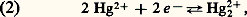 avec E0 = 0,920 V;
avec E0 = 0,920 V;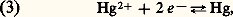 avec E0 = 0,854 V;
avec E0 = 0,854 V;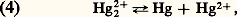 avec K = [Hg2+] / [Hg22+] = 6 . 10-3.Ces valeurs montrent que seuls les agents oxydants possédant un potentiel compris entre 0,79 et 0,85 V peuvent oxyder le mercure en HgI et non en HgII. Aucun agent oxydant usuel ne répondant à cette condition, lorsque le mercure est traité avec un excès d’oxydant, il est entièrement transformé en HgII. Cependant, si le mercure est au moins en excès de 50 p. 100, seul du mercure HgI est obtenu, le mercure réduisant HgII en HgI (4). La constante d’équilibre de la réaction (4) montre néanmoins que Hg22+ n’est stable que dans un domaine de concentration limité; tous les réactifs susceptibles de déplacer l’équilibre (précipitation ou formation de complexes) produisent la dismutation des sels mercureux en mercure métallique et en sels mercuriques.Composés mercuriquesLe mercure à l’état mercurique forme des composés stables avec l’azote, le chlore, le brome, l’iode et le soufre; il forme également des composés avec l’oxygène et le fluor, mais les liaisons dans ces composés sont facilement rompues. Les sels mercuriques qui devraient contenir l’ion mercurique Hg2+ ressemblent aux sels de l’ion hydroxonium H3+ dans lequel le degré d’ionisation varie avec la nature de l’anion.Halogénures mercuriquesLe fluorure est essentiellement ionique, il possède la structure de la fluorine Ca2. La distance Hg 漣F de 0,240 nm est pratiquement égale à la somme des rayons ioniques (r Hg+2 = 0,110 nm et r F- = 0,133 nm). C’est un électrolyte fort, mais il est hydrolysé en solution aqueuse en raison de la faiblesse de l’hydroxyde Hg(OH)2.Contrairement au fluorure, les autres halogénures montrent un caractère covalent très marqué, surtout le chlorure mercurique HgCl2 (sublimé corrosif). Ce dernier cristallise, en effet, dans un réseau où les molécules HgCl2 sont très individualisées. Le bromure et l’iodure cristallisent dans un réseau à couches. La solubilité dans l’eau des chlorures, bromures et iodures est très faible; elle est, par contre, relativement importante dans de nombreux solvants organiques. Le tableau 2 résume les propriétés des halogénures mercuriques.Oxyde, hydroxyde et sulfureL’oxyde mercurique existe sous deux formes allotropiques: une variété rouge de symétrie orthorhombique et une variété jaune de symétrie rhomboédrique. L’oxyde mercurique s’obtient par action de l’air ou de l’oxygène sur le mercure au-dessous de 300 0C. C’est un oxyde basique soluble dans les acides dilués, mais peu soluble dans l’eau (10-3 à 10-4 mole/litre).L’hydroxyde de mercure Hg(OH)2 existe en solution aqueuse, mais n’a jamais pu être isolé; il est amphotère, mais à caractère très faiblement basique:
avec K = [Hg2+] / [Hg22+] = 6 . 10-3.Ces valeurs montrent que seuls les agents oxydants possédant un potentiel compris entre 0,79 et 0,85 V peuvent oxyder le mercure en HgI et non en HgII. Aucun agent oxydant usuel ne répondant à cette condition, lorsque le mercure est traité avec un excès d’oxydant, il est entièrement transformé en HgII. Cependant, si le mercure est au moins en excès de 50 p. 100, seul du mercure HgI est obtenu, le mercure réduisant HgII en HgI (4). La constante d’équilibre de la réaction (4) montre néanmoins que Hg22+ n’est stable que dans un domaine de concentration limité; tous les réactifs susceptibles de déplacer l’équilibre (précipitation ou formation de complexes) produisent la dismutation des sels mercureux en mercure métallique et en sels mercuriques.Composés mercuriquesLe mercure à l’état mercurique forme des composés stables avec l’azote, le chlore, le brome, l’iode et le soufre; il forme également des composés avec l’oxygène et le fluor, mais les liaisons dans ces composés sont facilement rompues. Les sels mercuriques qui devraient contenir l’ion mercurique Hg2+ ressemblent aux sels de l’ion hydroxonium H3+ dans lequel le degré d’ionisation varie avec la nature de l’anion.Halogénures mercuriquesLe fluorure est essentiellement ionique, il possède la structure de la fluorine Ca2. La distance Hg 漣F de 0,240 nm est pratiquement égale à la somme des rayons ioniques (r Hg+2 = 0,110 nm et r F- = 0,133 nm). C’est un électrolyte fort, mais il est hydrolysé en solution aqueuse en raison de la faiblesse de l’hydroxyde Hg(OH)2.Contrairement au fluorure, les autres halogénures montrent un caractère covalent très marqué, surtout le chlorure mercurique HgCl2 (sublimé corrosif). Ce dernier cristallise, en effet, dans un réseau où les molécules HgCl2 sont très individualisées. Le bromure et l’iodure cristallisent dans un réseau à couches. La solubilité dans l’eau des chlorures, bromures et iodures est très faible; elle est, par contre, relativement importante dans de nombreux solvants organiques. Le tableau 2 résume les propriétés des halogénures mercuriques.Oxyde, hydroxyde et sulfureL’oxyde mercurique existe sous deux formes allotropiques: une variété rouge de symétrie orthorhombique et une variété jaune de symétrie rhomboédrique. L’oxyde mercurique s’obtient par action de l’air ou de l’oxygène sur le mercure au-dessous de 300 0C. C’est un oxyde basique soluble dans les acides dilués, mais peu soluble dans l’eau (10-3 à 10-4 mole/litre).L’hydroxyde de mercure Hg(OH)2 existe en solution aqueuse, mais n’a jamais pu être isolé; il est amphotère, mais à caractère très faiblement basique: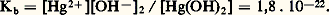 Le sulfure mercurique HgS fraîchement précipité est noir, son produit de solubilité est très faible (10-54), le sulfure noir se transforme par chauffage en cinabre de couleur rouge. La structure cristalline du cinabre est de type NaCl distordu, entraînant la formation de chaînes Hg 漣S.Autres selsParmi les sels mercuriques présentant un caractère ionique très marqué, on peut citer le nitrate, le sulfate et le perchlorate. Ils sont hydrolysés en solution et ne sont donc stables qu’en milieu acide. Les cyanure, oxalate, phosphate et thiocyanate se rapprochent des halogénures et sont, par conséquent, peu ou pas dissociés en solution.Complexes mercuriquesL’ion mercurique Hg2+ a une forte tendance à former principalement des complexes à coordinence 2 et 4 (hybridation sp et sp 3). Les coordinences 5 et 8 sont plus rares. Les complexes les plus stables sont ceux formés avec les halogénures, le carbone, l’azote, le phosphore et le soufre. Avec les halogènes, on peut citer (HgX)+, HgX2, (HgX3)-, et (HgX4)2-. Avec le cyanure et le thiocyanate, on obtient [Hg(CN)4]2- et [Hg(SCN)4]2-.Composés organo-mercuriquesLa liaison covalente entre le mercure et le carbone est particulièrement forte et remarquable par son inertie chimique. Un nombre important de composés organo-mercuriques qui possèdent des propriétés chimiques et physiologiques intéressantes sont connus. Ils sont de type RHgX et R2Hg (R = radical alkyl ou aryl). Les composés RHgX sont des solides cristallisés dont les propriétés dépendent de la nature de X. Les composés R2Hg sont en général des liquides volatils et toxiques ou des solides à bas point de fusion.Composés mercureuxS’il n’y a pas d’ambiguïté sur la structure de l’ion mercurique Hg2+, il faut savoir que l’ion mercureux doit s’écrire (Hg 漣Hg)2+, où deux atomes de mercure sont liés par covalence, le mercure montrant ainsi un seul degré d’oxydation + II. Les composés mercureux sont obtenus par action d’un élément ou d’un acide sur du mercure en excès. La liaison dans ces composés est à prédominance covalente. Les sels mercureux dérivent d’une base faible et, par conséquent, seront hydrolysés en solution. Ces composés sont relativement instables et ont tendance à se dismuter en mercure et en composés mercuriques. Les sels mercureux forment également des complexes peu stables.AmalgamesL’action des métaux sur le mercure conduit à la formation d’alliages métalliques, souvent liquides à la température ordinaire et portant le nom d’amalgames. Initialement, le nom d’amalgame était réservé à la substance obtenue par action de l’or sur le mercure; il est actuellement utilisé pour désigner les systèmes analogues formés avec les autres métaux, ou les espèces chimiques définies et cristallisées qui résultent de la combinaison du mercure avec n’importe quel autre métal. Il existe donc deux sortes d’amalgames, ceux obtenus en saturant le mercure par un métal étranger et ceux résultant de l’analyse thermique des composés binaires Hg 漣métal. Une étude détaillée montre que le mercure réagit pratiquement avec tous les métaux et particulièrement avec les métaux alcalins et alcalino-terreux.Propriétés physiologiques et usagesLe mercure et ses composés sont très toxiques. La vapeur de mercure et les composés, même peu solubles, sont mortels à des doses de l’ordre de 0,5 à 1 g suivant l’individu et la nature du sel. Un certain nombre de composés du mercure, surtout organo-mercuriques, employés à faibles doses, possèdent des propriétés thérapeutiques variées.Le mercure, en raison de ses propriétés physiques remarquables (état liquide, densité élevée, tension de vapeur faible, etc.), est très largement utilisé dans les baromètres, polarographie, thermomètres, régulateurs de débit gazeux, jauges de McLeod, pompes à diffusion de vapeur de mercure pour vides très poussés, lampes à vapeur de mercure. Dans les appareillages électriques, le mercure sert de commutateur, d’interrupteur, de redresseur de courant. Le mercure est encore employé pour la préparation de nombreux amalgames dont les propriétés réductrices ont reçu de multiples applications analytiques ou industrielles (préparation du chlore et de la soude). Les amalgames d’argent et d’étain sont utilisés en chirurgie dentaire pour l’obturation des caries. Le mercure est également un catalyseur de nombreuses synthèses organiques.
Le sulfure mercurique HgS fraîchement précipité est noir, son produit de solubilité est très faible (10-54), le sulfure noir se transforme par chauffage en cinabre de couleur rouge. La structure cristalline du cinabre est de type NaCl distordu, entraînant la formation de chaînes Hg 漣S.Autres selsParmi les sels mercuriques présentant un caractère ionique très marqué, on peut citer le nitrate, le sulfate et le perchlorate. Ils sont hydrolysés en solution et ne sont donc stables qu’en milieu acide. Les cyanure, oxalate, phosphate et thiocyanate se rapprochent des halogénures et sont, par conséquent, peu ou pas dissociés en solution.Complexes mercuriquesL’ion mercurique Hg2+ a une forte tendance à former principalement des complexes à coordinence 2 et 4 (hybridation sp et sp 3). Les coordinences 5 et 8 sont plus rares. Les complexes les plus stables sont ceux formés avec les halogénures, le carbone, l’azote, le phosphore et le soufre. Avec les halogènes, on peut citer (HgX)+, HgX2, (HgX3)-, et (HgX4)2-. Avec le cyanure et le thiocyanate, on obtient [Hg(CN)4]2- et [Hg(SCN)4]2-.Composés organo-mercuriquesLa liaison covalente entre le mercure et le carbone est particulièrement forte et remarquable par son inertie chimique. Un nombre important de composés organo-mercuriques qui possèdent des propriétés chimiques et physiologiques intéressantes sont connus. Ils sont de type RHgX et R2Hg (R = radical alkyl ou aryl). Les composés RHgX sont des solides cristallisés dont les propriétés dépendent de la nature de X. Les composés R2Hg sont en général des liquides volatils et toxiques ou des solides à bas point de fusion.Composés mercureuxS’il n’y a pas d’ambiguïté sur la structure de l’ion mercurique Hg2+, il faut savoir que l’ion mercureux doit s’écrire (Hg 漣Hg)2+, où deux atomes de mercure sont liés par covalence, le mercure montrant ainsi un seul degré d’oxydation + II. Les composés mercureux sont obtenus par action d’un élément ou d’un acide sur du mercure en excès. La liaison dans ces composés est à prédominance covalente. Les sels mercureux dérivent d’une base faible et, par conséquent, seront hydrolysés en solution. Ces composés sont relativement instables et ont tendance à se dismuter en mercure et en composés mercuriques. Les sels mercureux forment également des complexes peu stables.AmalgamesL’action des métaux sur le mercure conduit à la formation d’alliages métalliques, souvent liquides à la température ordinaire et portant le nom d’amalgames. Initialement, le nom d’amalgame était réservé à la substance obtenue par action de l’or sur le mercure; il est actuellement utilisé pour désigner les systèmes analogues formés avec les autres métaux, ou les espèces chimiques définies et cristallisées qui résultent de la combinaison du mercure avec n’importe quel autre métal. Il existe donc deux sortes d’amalgames, ceux obtenus en saturant le mercure par un métal étranger et ceux résultant de l’analyse thermique des composés binaires Hg 漣métal. Une étude détaillée montre que le mercure réagit pratiquement avec tous les métaux et particulièrement avec les métaux alcalins et alcalino-terreux.Propriétés physiologiques et usagesLe mercure et ses composés sont très toxiques. La vapeur de mercure et les composés, même peu solubles, sont mortels à des doses de l’ordre de 0,5 à 1 g suivant l’individu et la nature du sel. Un certain nombre de composés du mercure, surtout organo-mercuriques, employés à faibles doses, possèdent des propriétés thérapeutiques variées.Le mercure, en raison de ses propriétés physiques remarquables (état liquide, densité élevée, tension de vapeur faible, etc.), est très largement utilisé dans les baromètres, polarographie, thermomètres, régulateurs de débit gazeux, jauges de McLeod, pompes à diffusion de vapeur de mercure pour vides très poussés, lampes à vapeur de mercure. Dans les appareillages électriques, le mercure sert de commutateur, d’interrupteur, de redresseur de courant. Le mercure est encore employé pour la préparation de nombreux amalgames dont les propriétés réductrices ont reçu de multiples applications analytiques ou industrielles (préparation du chlore et de la soude). Les amalgames d’argent et d’étain sont utilisés en chirurgie dentaire pour l’obturation des caries. Le mercure est également un catalyseur de nombreuses synthèses organiques.
Encyclopédie Universelle. 2012.
